推荐产品
公司新闻/正文
新模型 NOG-EXL:如何助力肿瘤药物探索之路?
人阅读 发布时间:2021-06-09 15:09

近年来肿瘤免疫治疗在临床上的应用取得了突破性进展,打破肿瘤微环境免疫抑制机制将是肿瘤免疫研究下一步的研究方向。寻找更完善的免疫系统人源化模型,在进行抗肿瘤药物治疗时,能够利用人的免疫系统与肿瘤相互作用,成为了研究者争相追逐的热点。
在以初代 NOG/NSG 小鼠为背景的免疫系统重建模型中无法有效重建髓系细胞,科学家一直在探索更优化的体内模型解决这一问题,国际上曾报道过 NOG-EXL, NSG™-SGM3 以及 MISTRG 三种细胞因子转基因模型均可成功移植 huHSC,且重建人髓系细胞水平高于对照组的基础免疫缺陷模型。那么这三种模型在肿瘤免疫治疗的实际应用如何呢?
科学家 Maser I-P 对人源化 NOG-EXL 和 NSG-SGM3 的研究表明,NOG-EXL 小鼠经过人源化后能模拟人类免疫细胞的组成,且能保证存活率。今天我们将深入解读 NOG-EXL 小鼠为何能够脱颖而出并将如何助力于您的肿瘤药物研发?
![]()
NOG-EXL 小鼠
NOG 与 NOG-EXL 小鼠
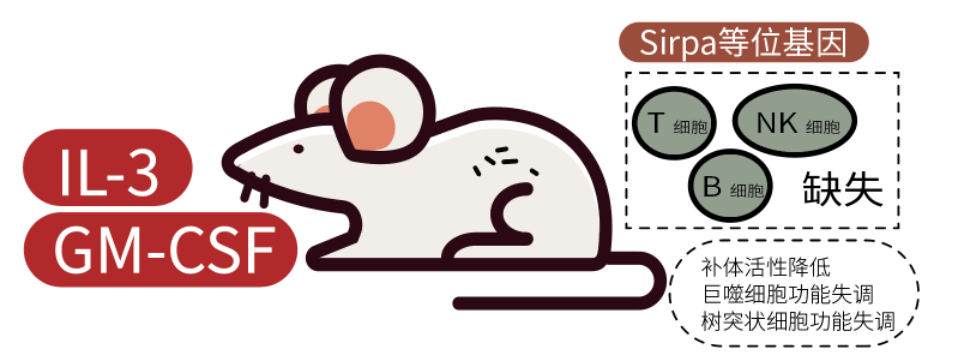
我们今天的主角 NOG-EXL 小鼠是新一代 NOG 小鼠衍生品系,是在 NOG 小鼠基础上引入编码人类 IL-3 和 GM-CSF 的转基因小鼠, 与基础 NOG/NSG 小鼠相比,huHSC 移植后,人源的单核细胞、树突状细胞和其他重要的细胞类型均有大幅增加, 呈现了更完整的人类免疫系统。
NOG 小鼠具备超重度免疫缺陷特性(T、B、NK 细胞缺失),补体活性降低,巨噬细胞和树突状细胞功能失调,携带 NOD 背景中特异性 Sirpa 等位基因,这些特性使其成为人的免疫系统移植的优质宿主。
![]()
NOG-EXL 小鼠如何突破人髓系细胞分化障碍❓
髓系靶点的重要性
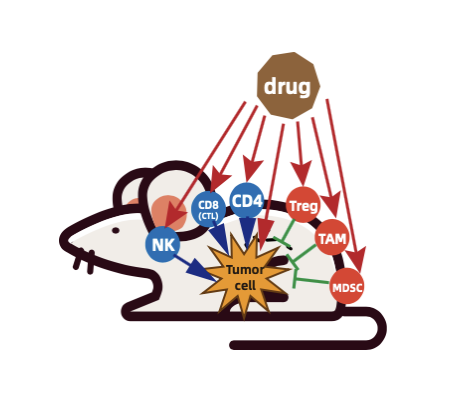
随着 PD-1, PD-L1/CTLA4 抗体在多种肿瘤类型的部分患者中表现出较为持久的抗肿瘤效应,免疫检查点抑制剂(ICIs)已经显著改变了癌症的治疗方法。然而,这些抗体并不是普遍有效的,临床上大约 80% 患者对 ICIs 治疗没有应答,这表明它们可能无法有效刺激抗肿瘤免疫系统。
研发人员更多地意识到先天性免疫系统及肿瘤微环境在肿瘤的发生发展中发挥了重要的作用,也将研发重点转移至先天免疫系统来辅助进行肿瘤的免疫治疗,如髓系细胞 MDSCs(骨髓来源的抑制细胞)和 TAMs (肿瘤相关巨噬细胞),NK 细胞和 DC 细胞等,并取得了显著的效果。
NOG-EXL 小鼠突破瓶颈
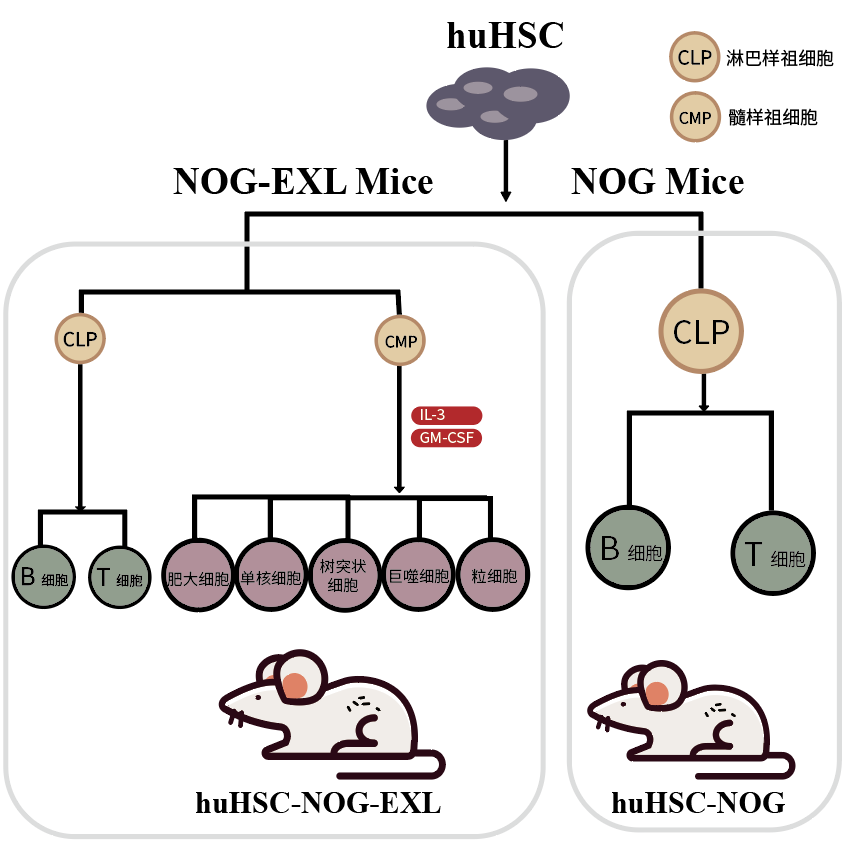
将人的 HSC 移植到 NOG 小鼠中的最大挑战在于:HSC 在分化的过程中,髓系细胞前体需要特定的细胞因子信号进行进一步的分化。然而,一些内源性的鼠源细胞因子不能充分地与人源的细胞因子受体相互作用,导致髓系细胞分化率非常低,因此在小鼠体内成熟的髓系细胞数量非常少。
通过不同方式补充人的细胞因子,均可实现髓系细胞的重建。可以通过给小鼠注射外源的人类细胞因子,也可以通过不同的基因转染方式实现这一目标。但日本 CIEA 的 Mamoru Ito(CIEA NOG 小鼠的创始人)的研究表明,引入编码人类 IL-3 和 GM-CSF 的转基因 NOG 小鼠,将会是更简单有效的一种方式。简单来说,CD34+移植后的 huNOG-EXL 小鼠体内呈现更完整的人类免疫系统,包括成熟的粒细胞,单核细胞,巨噬细胞,B 细胞和 T 细胞。
![]()
huHSC-NOG-EXL 小鼠「实例」证实自身优势
huHSC-NOG-EXL 人源化小鼠中髓系细胞表达上升,呈现了更完整的人的免疫系统,为肿瘤免疫治疗的临床前研究提供了较好的体内研究平台,极大地促进及改善了肿瘤免疫疗法的研发进程。
生物制药公司 Tesaro 的研究者利用 huNOG-EXL 小鼠制备的 NSCLC(A549 细胞系移植)肿瘤模型进行联合治疗(两种 LAG-3 抗体)的抗肿瘤研究,结果展示了联合疗法显著增强了抗肿瘤效应。进一步对肿瘤内部免疫细胞的流式结果表明,与对照组相比,治疗组小鼠肿瘤内浸润淋巴细胞(TIL)增加。同时,PD-1 和 LAG-3 抗体的联合给药也降低肿瘤相关巨噬细胞 (TAM) 的总体频率,特别是免疫抑制型 M2 巨噬细胞的含量。²
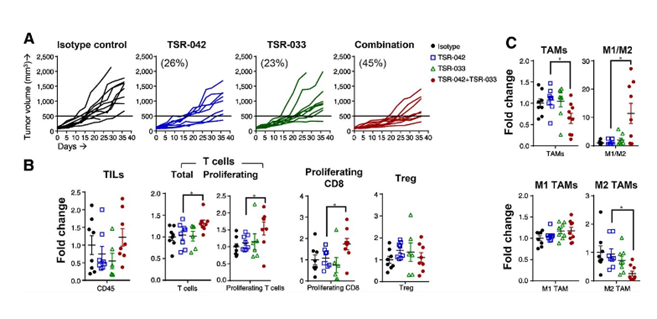
Champions Oncology 的研究也发现 huNOG-EXL 小鼠进行 PDX 移植后,在肿瘤内部有淋巴细胞和髓系细胞的浸润:CD3+ 细胞、MDSCs 和 T 细胞亚群等等,可用于免疫肿瘤治疗中新的靶点药物的评估。³
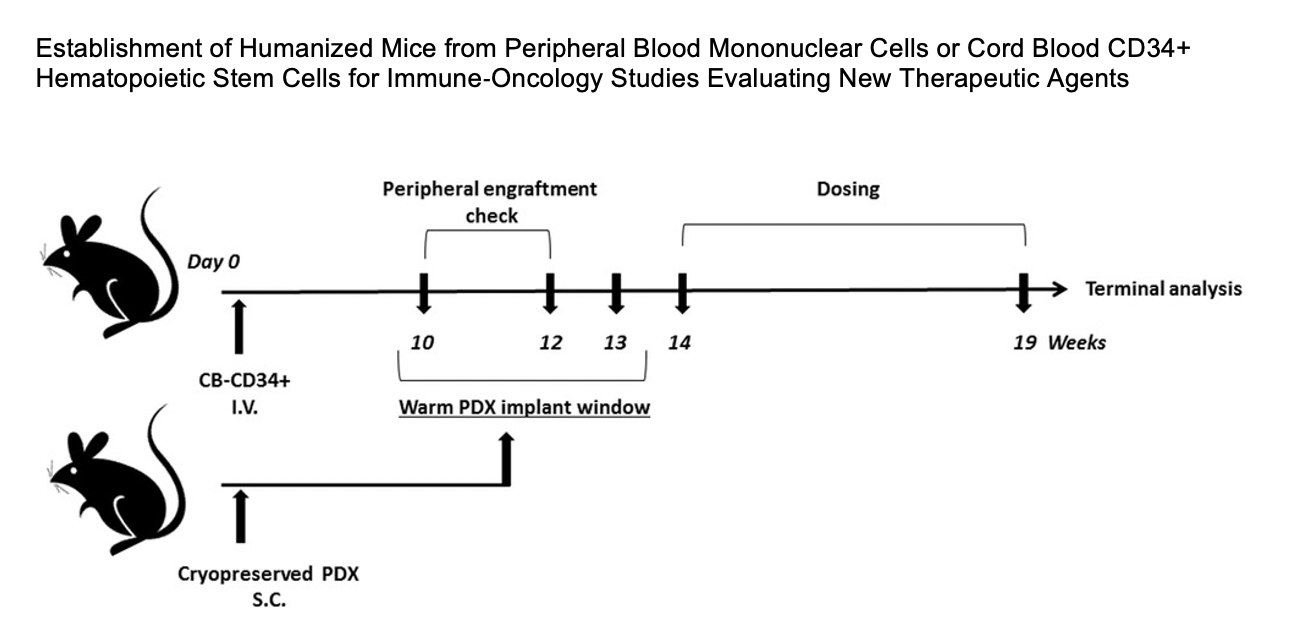
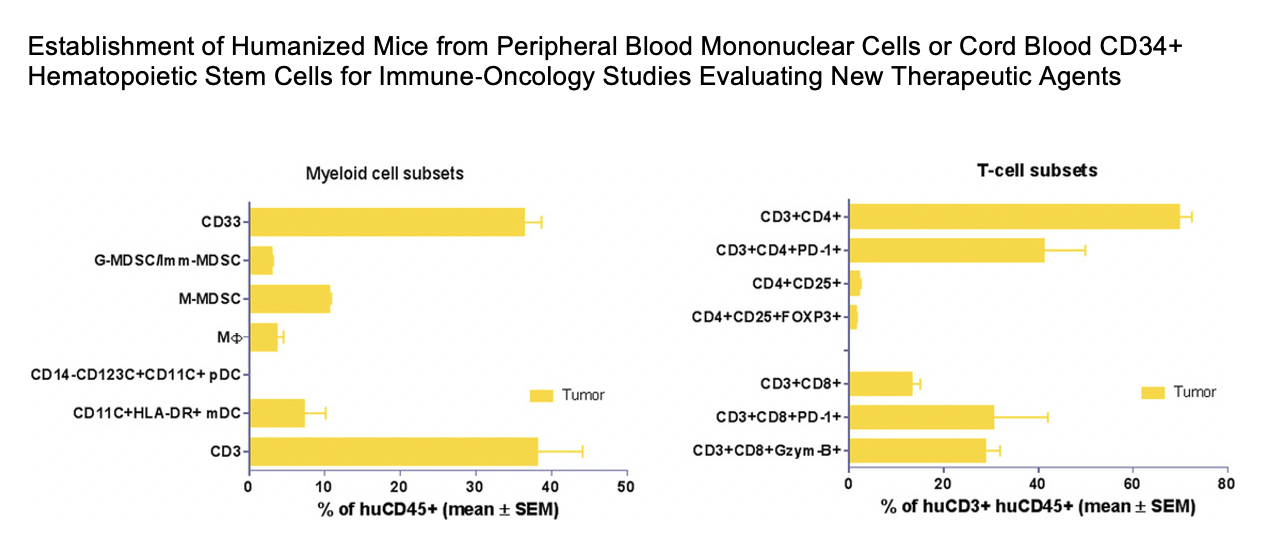
在另一项研究中由 Tesaro 和 Charles River 将三种不同类型的肿瘤植入 huNOG-EXL 小鼠体内,并在这些肿瘤中鉴定出不同的人类淋巴和髓系细胞。
这些研究表明 huNOG-EXL 小鼠能够成功植入关键的人类免疫细胞类型,并为肿瘤生长和治疗提供充足的时间窗口支持 IO 研究。
NOG-EXL 作为人源化的优选宿主
制备任何人源化免疫系统模型时都可能受到供体细胞固有特性的影响,单个供体批次内移植时的失败率(定义为人源化后嵌合率小于 25% 的现象)也因供体而异。
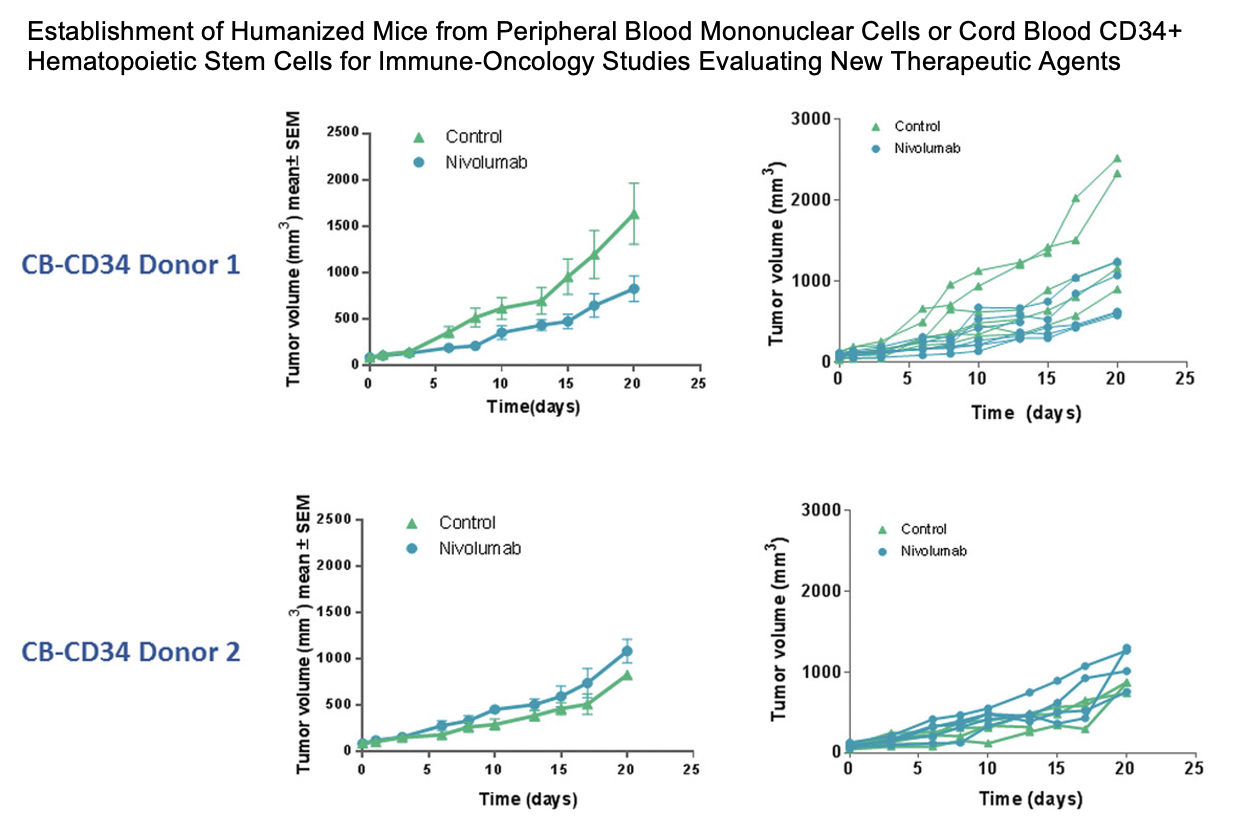
与第一代 NOG/NSG 等超重度免疫缺陷小鼠相比,CD34+ 人源化 NOG-EXL 小鼠的批次内失败率(定义为人源化后嵌合率小于 25% 的现象)要低很多。Champions Oncology 的数据展示,当 NOG-EXL 小鼠被植入四个单供体的干细胞时,观察到接近零的失败率。而 NOG 小鼠由于没有人类细胞因子辅助,在所有批次的供体中都会有部分的失败情况发生。
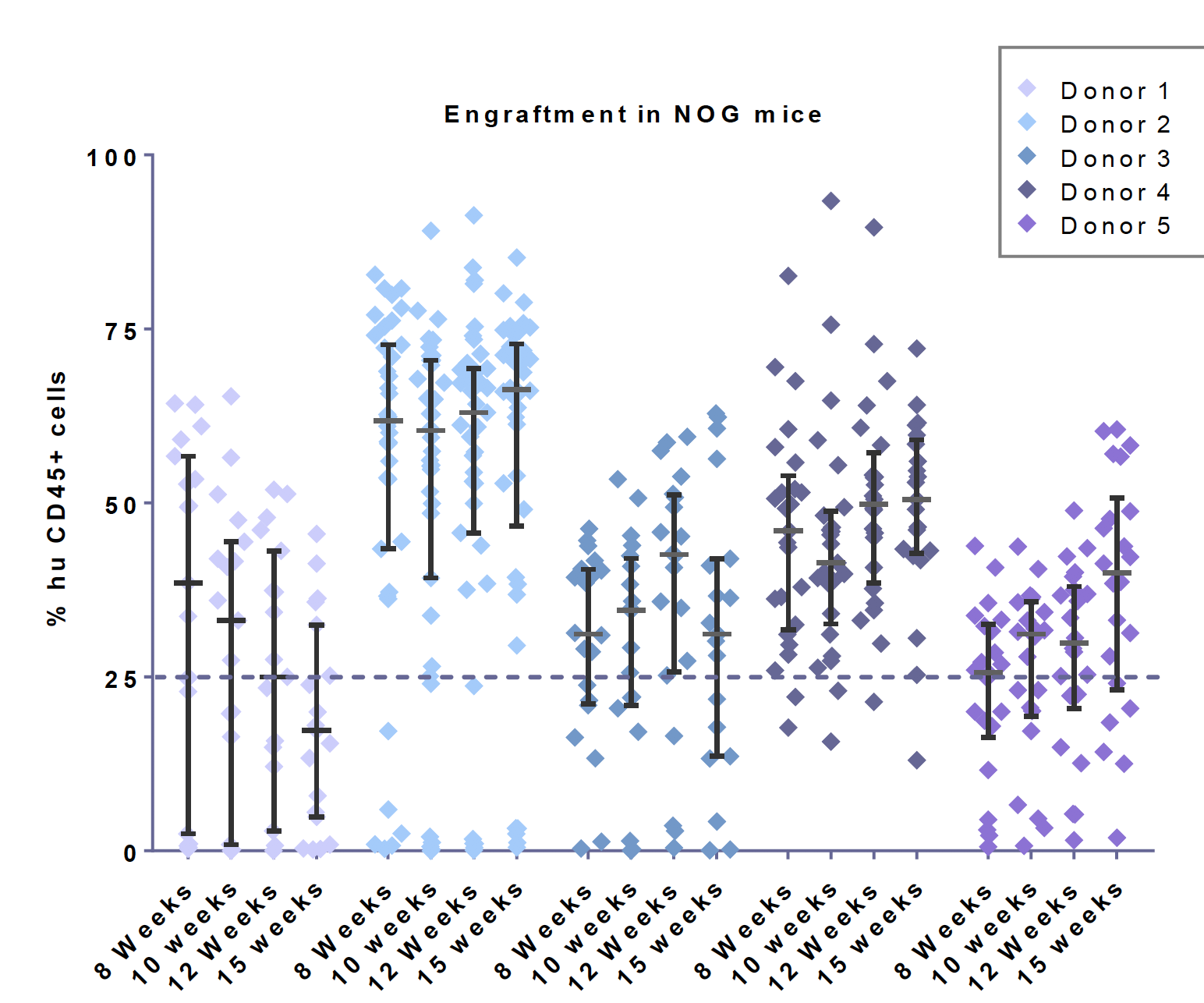
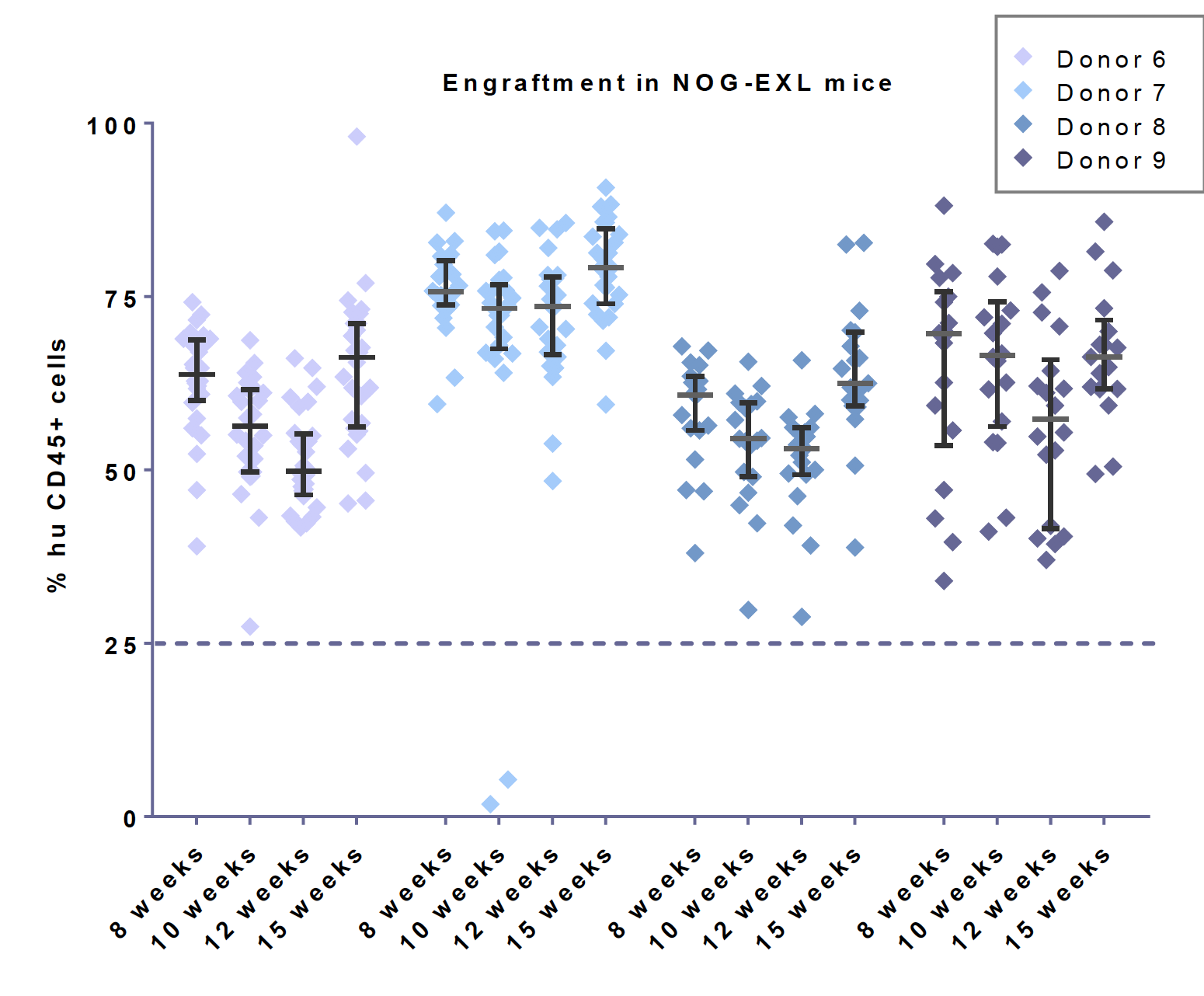
NOG-EXL 比 NOG 小鼠采用单供体人脐血源 CD34+HSC 的植入成功率高。
NOG-EXL 凭何脱颖而出?
包括 NOG-EXL 小鼠在内,目前科学家已探索了几种通过转入人细胞因子基因增强髓系细胞分化的动物模型,比如 NSG-SGM3、MISTRG。这几种看起来设计原理类似的模型,应用于研发试验中,究竟有何不同之处呢?我们总结了文献报道的一些内容,可供大家参考。
NSG™-SGM3
这个 NSG™-SGM3,也称为 NSGS,在 NSG 上表达三种不同的人类细胞因子 GM-CSF、IL-3 和 KITLG 。该转基因模型使用了相对较强的病毒 CMV 启动子,并导致细胞因子的表达水平为超生理水平。
MISTRG
MISTRG 基本模型是在 BALB/c x 1292S4 混合背景上的 Rag2/Il2rg 双敲除。由于该背景(与 NOD 不同)不适合人类干细胞的植入,因此添加了一个表达人 SIRPα 的转基因来改善造血干细胞(HSC)的植入。此外,该模型还表达人 GM-CSF、IL-3、M-CSF 和 TPO。除 hGM-CSF 外,这些细胞因子均位于内源性小鼠启动子下。
MISTRG 由耶鲁大学 Richard Flavell 设计,并与 Regeneron Pharmaceuticals 合作制造。杰克逊实验室曾在 2015 年引进该品系,然而随后就停止了 MISTRG 的生产。
研究者 Maser I-P 通过对人源化 NOG-EXL 和 NSG-SGM3 的研究表明,NOG-EXL 小鼠经过人源化后最能模拟人类免疫细胞的组成,并提高了存活率。
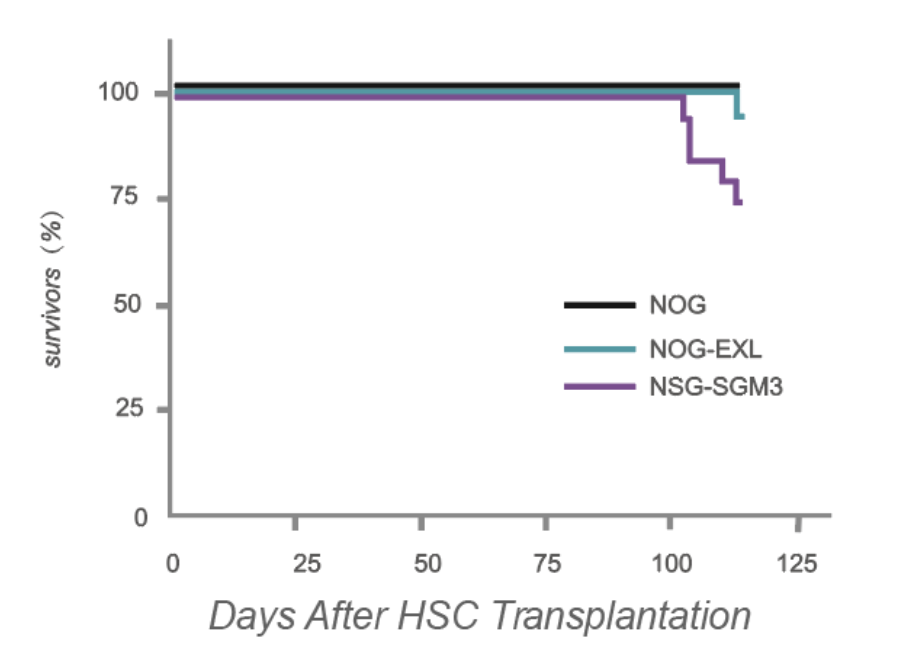
与人源化 NSG-SGM3 相比,人源化 NOG-EXL 小鼠的存活率明显升高,源自 Maser I-P 等的研究结果。
文献报道 NSG-SGM3 在 huHSC 移植后,100% 的小鼠在移植后 10 至 27 周内死亡⁴,而所有未植入的对照组小鼠都正常存活,进一步研究发现原因为 NSG-SGM3 小鼠过量表达人细胞因子 IL-3、GM-CSF 和 SF(2000-4000pg/mL),导致造血干细胞分化加速,过早衰竭,进而发生严重的致死性贫血,很大程度上限制了其在肿瘤免疫研究中的应用。
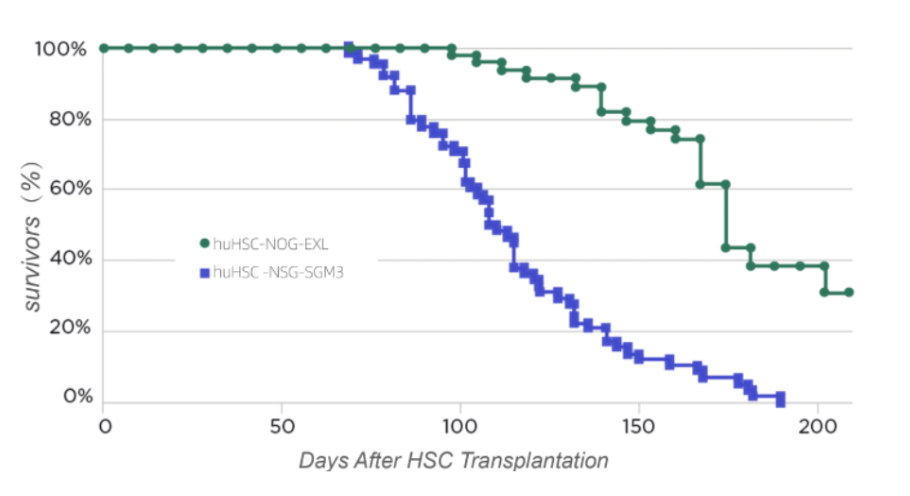
NSG-SGM3 移植数据来源文献:A xenograft model of macrophage activation syndrome amenable to anti-CD33 and anti-IL-6R treatment。
移植后 16 周,大约 50% 的人源化 NSG-SGM3 小鼠会死于贫血,而 huHSC-NOG-EXL 存活率仍高于 90%。此外,在移植后 30 周,人源化 NSG-SGM3 小鼠全部死于贫血后,huNOG-EXL 存活率仍超过 30%。
相比之下,虽然 huHSC-NOG-EXL 小鼠随着时间的推移也会出现轻微贫血现象,但绝大多数不会发展为严重的贫血,存活时间远远超过了人源化 NSG-SGM3。究其原因为 NOG-EXL 小鼠表达人细胞因子更接近生理水平 (GM-CSF 和 IL-3 细胞因子水平分别为~35pg/mL 和~80pg/mL)。⁵
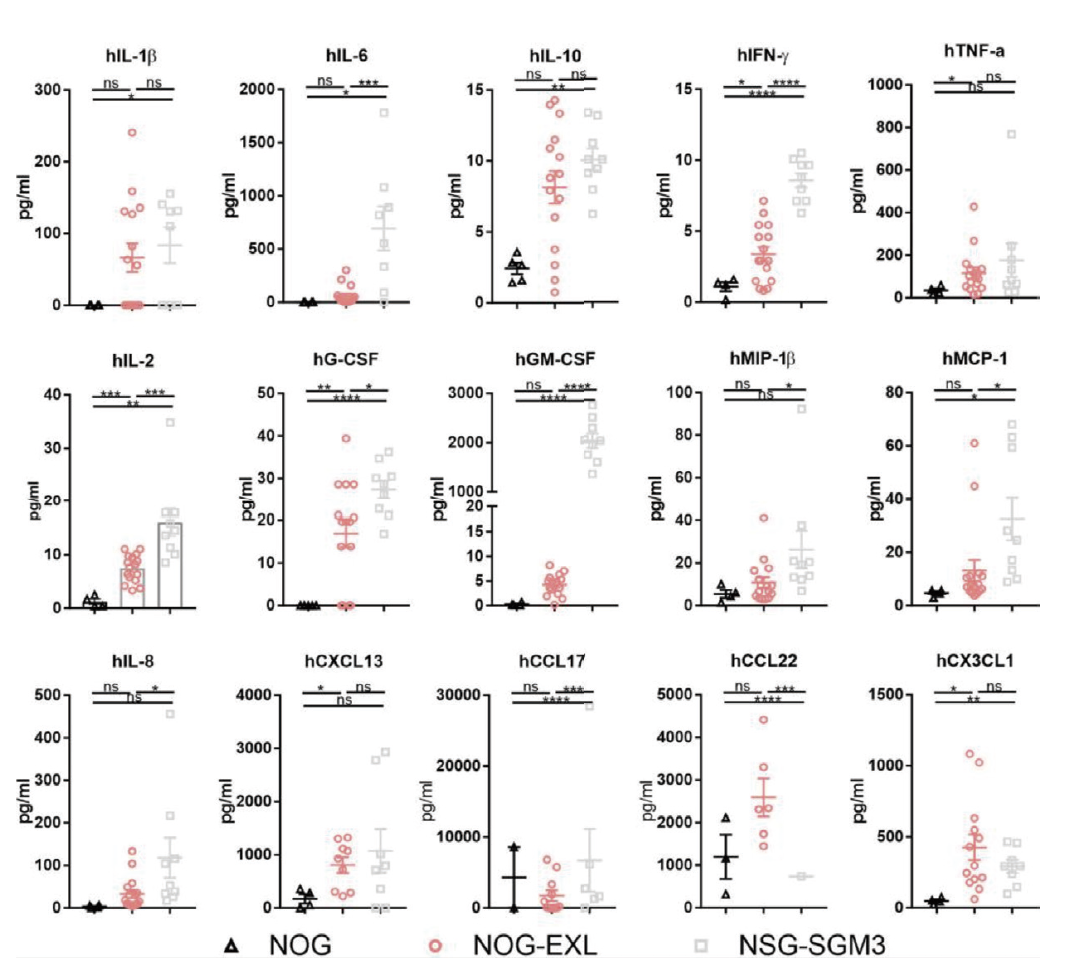
用 Bio-Plex 分析人源化小鼠血清中的人细胞因子和趋化因子。源自 Maser I-P 等的研究结果。
huHSC 人源化后,与 NOG 小鼠相比,NOG-EXL 和 NSG-SGM3 均显示出人类细胞因子谱显著增加。与人源化 NSG-SGM3 中的促炎因子相比,人源化 NOG-EXL 小鼠具有更生理、低炎症的细胞因子谱。
关于 NOG-EXL 模型更多应用方向您了解吗?
上文中我们详述了 NOG-EXL 小鼠用于 huHSC 人源化移植时的显著优势,其实 NOG-EXL 小鼠的宝藏应用不止于此!
结合 NOG-EXL 小鼠的特性,您知道 NOG-EXL 小鼠可用于以下哪些研究领域吗? A CAR-T 药物的安全性评价 B 构建 AML PDX 模型 C 肿瘤免疫治疗研究 D 过敏哮喘等炎症研究
(点击空白处查看答案)
▼
答案:「ABCD」
A. CAR-T 药物在杀伤肿瘤细胞的同时,可能会产生细胞因子释放综合征(cytokine release syndrome,CRS)的副反应,采用常规免疫缺陷小鼠荷瘤模型通常情况下观察到的细胞因子释放是有限的, 不能有效地评估 CAR-T 细胞治疗的安全性。昭衍研究结果表明,对 huHSC-NOG-EXL 给与肿瘤负荷并输注 CAR-T 细胞后,可观察到明显的各类细胞因子释放,相比于常规的荷瘤小鼠,免疫重建的 NOG-EXL 小鼠是更适合的模型。
B. NOG-EXL 小鼠表达的人源细胞因子 GM-CSF 与 IL-3,是人髓系细胞成长和分裂所需主要细胞因子,更利于 AML 细胞在小鼠体内的增殖。Champions Oncology 公司的 AML PDX 移植数据表明,AML PDX 模型有助于保持肿瘤组织的异质性,且 NOG-EXL 小鼠可增强移植效果。
C. 人源化 NOG-EXL 小鼠(huHSC-NOG-EXL)不仅能研究效应 T 细胞及调节 T 细胞的功能,也能研究浸润于肿瘤内部的髓系细胞与肿瘤的相互作用,可以在一个动物模型内研究更多免疫细胞参与的肿瘤免疫疗法。
D. huHSC-NOG-EXL 由于能够分化出肥大细胞及粒细胞等,可用于过敏、哮喘及其他炎症研究
小结
涉及到髓系细胞及肿瘤微环境的药物研发时,huHSC-NOG-EXL 小鼠是优选的人源化模型。
1、huHSC-NOG-EXL 中人源的单核细胞、树突状细胞和其他重要的细胞类型均有大幅增加,人源免疫系统重建失败的风险降低。
2、与市场上现有模型相比(NSG-SGM3), 人源化 NOG- EXL 小鼠重建了一个更接近于人的免疫系统。NOG-EXL 小鼠经过人源化后最能模拟人类免疫细胞的组成,并提高了存活率。
3、维通利华 NOG-EXL 每只小鼠都经过基因型鉴定。
4、维通利华提供现成的 huHSC-NOG-EXL 模型(已验证的外周血人源免疫细胞重建率「hCD45 ≥ 25%」),以避免科研工作者 3-4 个月的等待时间。
如果您想了解你感兴趣的免疫细胞是否在人源化模型中重建并发挥作用,可与我们的技术人员进行科学咨询,讨论并选择最适合您研究的人源化模型。我们可以帮助规划您的研究,选择对您最合适的技术且最有价值的模型。
huHSC-NOG (现货)
huPBMC-NOG (订单生产,一周发货)
huHSC-NOG-EXL (现货)
huPBMC-NOG-dKO(订单生产,一周发货)
参考文献
1.Wang Z, Sun K, Xiao Y, et al. Niraparib activates interferon signaling and potentiates anti-PD-1 antibody efficacy in tumor models. Sci Rep. 2019;9(1):1853.
2.Ghosh S, Sharma G, Travers J, et al. TSR-033, a Novel Therapeutic Antibody Targeting LAG-3, Enhances T-Cell Function and the Activity of PD-1 Blockade and . Mol Cancer Ther.2019;18(3):632-641.
3.Verma B , Wesa A . Establishment of Humanized Mice from Peripheral Blood Mononuclear Cells or Cord Blood CD34+ Hematopoietic Stem Cells for Immune‐Oncology Studies Evaluating New Therapeutic Agents[J]. Current protocols in pharmacology, 2020, 89.
4.Maser I P , Hoves S , Bayer C , et al. The Tumor Milieu Promotes Functional Human Tumor-Resident Plasmacytoid Dendritic Cells in Humanized Mouse Models[J]. Frontiers in Immunology, 2020, 11:2082.
5.Wunderlich M , Stockman C , Devarajan M , et al. A xenograft model of macrophage activation syndrome amenable to anti-CD33 and anti–IL-6R treatment[J]. JCI Insight, 2016, 1(15).