推荐产品
公司新闻/正文
细胞治疗中动物模型的选择
人阅读 发布时间:2022-08-02 16:17
自2017年第一款CAR-T药物Kymriah被FDA批准以后,目前全球共有8款CAR-T 药物上市,并且全球的研发管线中,除了CAR-T以外,其他T细胞疗法(TCR-T、TIL、NKT、TAA-targeted T)及其他细胞疗法(NK、 DC、干细胞、髓系细胞)均有大幅增长。很多科学家预言,细胞治疗将成为未来肿瘤治疗的重要手段。
细胞治疗作为一种新兴的治疗手段,还有很多问题和挑战有待科学家及研发学者们解决,例如靶向实体瘤的有效性、复杂性细胞疗法的制备和临床实施障碍等。本文就CAR-T细胞的临床前体内试验这一环节,将讲述如何选择更优的动物模型,提高临床转化率。因为合适的临床前药效研究模型,可以加速免疫药物研发和开发新型组合疗法的进程,极大程度减少临床试验失败风险。
1.提及细胞治疗时, 我们首先选用什么动物模型呢?
选择合适的动物模型可用于CAR-T细胞功能的概念验证。但由于物种差异,在动物模型内会存在CAR-T细胞和肿瘤靶点的物种特异性、异种移植物抗宿主反应、在动物中模拟人类免疫反应困难等问题,没有一种完美的模型可以完全模拟临床上的反应。
但在人源化小鼠模型(在这里指人类肿瘤异种移植小鼠模型)中进行的体内试验可以提供有关CAR-T细胞药效、分布和增殖特征的信息。并且在这些人源化小鼠模型上进行的临床前测试和评估已经成为验证这些细胞疗法的黄金标准,并获得监管部门的批准。
2022年3月15日,FDA颁布《Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products》草案
这里的人源化模型,最广泛使用的是超重度免疫缺陷NOD/SCID/gamma(c)(null) mouse/ (NOG/NSG)小鼠,原因是什么呢?
- NOG小鼠缺乏小鼠T、B、NK和功能性树突状细胞,更容易接受人类肿瘤细胞系、肿瘤组织和健康组织的移植。
- CAR-T等人源T细胞,在NOG小鼠上被动物排斥较小,可进行CAR-T等细胞药物的有效评估。其他模型由于免疫系统的存在,会对人源细胞治疗药物进行排斥。这是细胞治疗需要选用超重度免疫缺陷鼠NOG非常重要的原因。
- NOG小鼠可支持人类造血干细胞的移植及免疫细胞的发育。
- NOG/NSG的异种移植模型已经为研究人类免疫系统和血液瘤之间相互作用的平台,尤其是血液瘤的PDX移植,可以同时将人的免疫细胞植入,比较好地模拟了肿瘤细胞以及肿瘤微环境(例如,免疫细胞)在体内的呈现。
Humanized Mice Are Precious Tools for Preclinical Evaluation of CAR T and CAR NK Cell Therapies
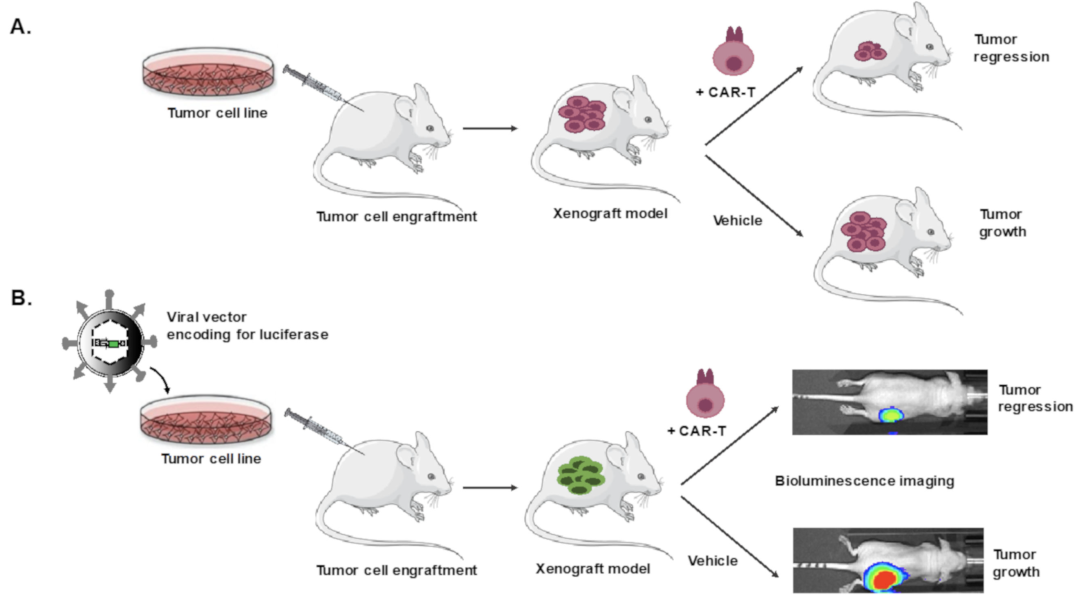
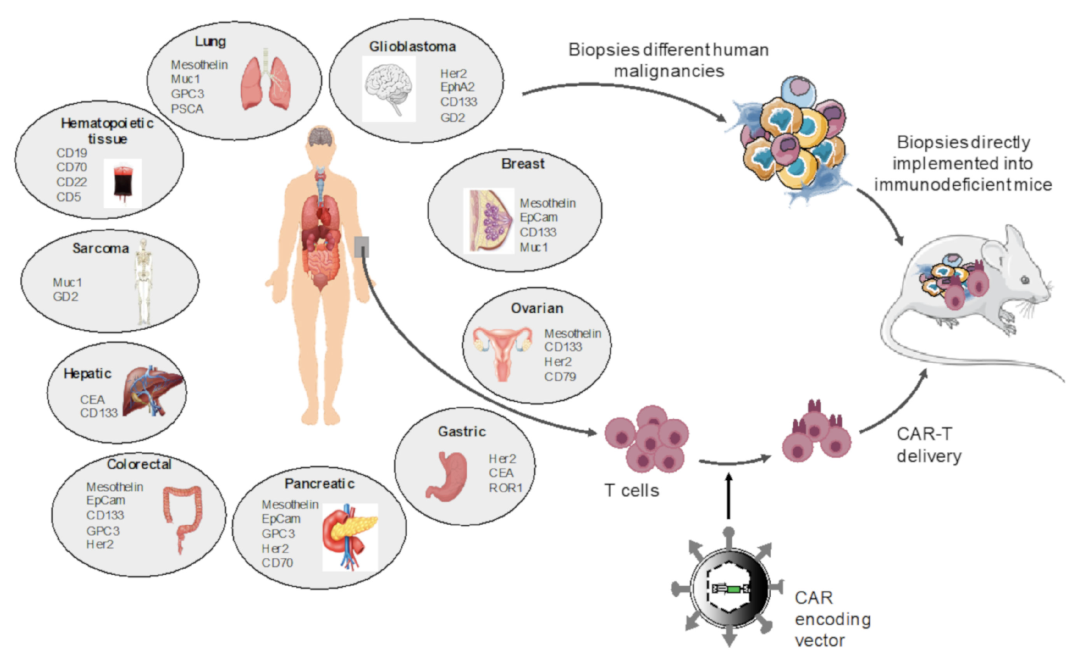
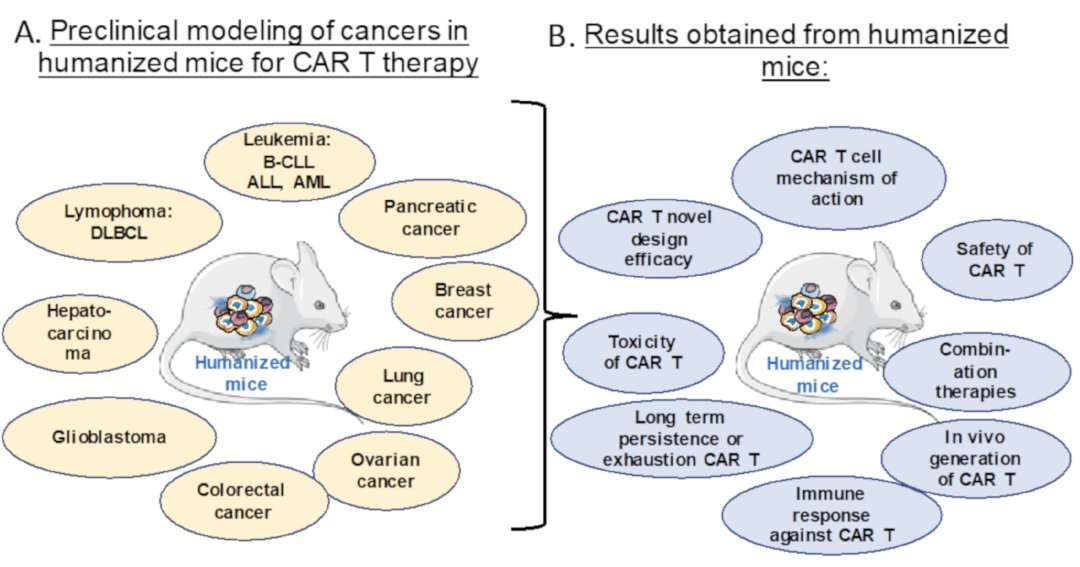
Preclinical modeling of CAR T Cell therapy in humanized cancer mice models.(A) Different humanized mice models for preclinical modeling of different malignancies.(B) The relevant preclinical data for CAR T cell treatment obtained for the indications in (A).

慢性淋巴细胞白血病(CLL)是成人最常见的白血病,一些患者接受CAR-T治疗后能够得到缓解,但很多患者由于T细胞衰老,疗效有限。
2022年Funk CR等的新近研究表明,CAR-T细胞培养过程中添加双pi3k δ/γ抑制剂duvelisib可以增加干细胞记忆性CD8+ CART细胞的产量,改变表观遗传修饰:CD4/CD8比值标准化、线粒体质量增加。赋予CD28和41BB CAR-T在NOG小鼠体内更大的体内扩张和抗肿瘤活性
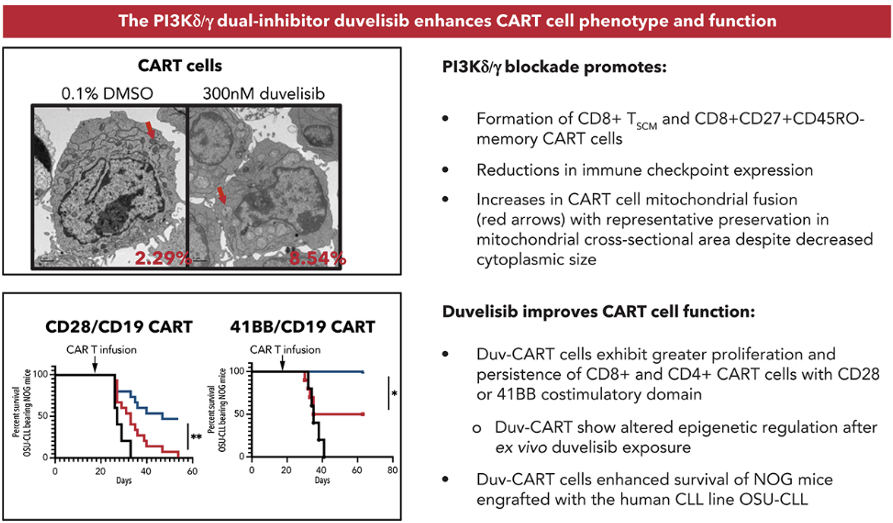
https://ashpublications.org/blood/article/139/4/523/476855/PI3K-inhibition-promotes-human-CART-cell
2.特殊情况下的更优模型选择
虽然NOG小鼠为细胞治疗的临床前功能药效提供了重要的数据支撑,但随着细胞治疗研究的深入及扩展,一些情况下需要新一代的NOG模型,才能更好地支持研究结果的准确性。
- 降低GvHD风险,长期的T细胞治疗药效评估
- 临床前T细胞治疗实体瘤,如何更贴近临床?
- NK细胞治疗如何摆脱临床前在小鼠体内无法发挥药效的困境?
这些情况下应该选择哪种更优的模型?我们一起来分析一下吧

虽然NOG小鼠在细胞治疗的临床前功能药效验证了发挥了非常重要的作用,但越来越多的研发学者发现将人成熟T细胞转移到NOG小鼠,会导致移植物抗宿主病(GvHD),这非常不利于CAR - T细胞治疗的长期药效评估。
Xeno-GvHD异种移植发生有以下三个先决条件
- 移植的T细胞有免疫活性
- 宿主对移植物来说是异己
- 宿主无力对移植物发动有效免疫攻势
人源PBMC或者CAR-T等来源的T细胞移植到NOG小鼠中,符合以上三个先决条件,导致GvHD会不可避免的发生。当然GvHD的严重程度也跟CAR-T细胞来源的donor,CAR设计的特异性,注射剂量等有关。
如何降低临床前动物实验由于物种差异,而导致的这种异源T细胞移植引起的Xeno-GvHD呢?如何更好地进行T细胞药物评估呢?
NOG-MHC I/II-2 KO(NOG-dKO)小鼠是推荐的临床前动物模型。NOG-dKO小鼠敲除了小鼠的MHC I/II 分子,使得移植的T细胞无法对小鼠识别,从而无法进行免疫攻击,大大减缓了GvHD, 为研发者提供了充足的研发周期。

由于CAR-T自体治疗的局限性,科学家们越来越倾向于选择异体来源T细胞,其中诱导性多能干细胞iPSCs是一重要来源。
2021年日本京都大学诱导多功能干细胞研究中心(Center for iPS Cell Research and Application (CiRA), Kyoto University)的研究结果表明:经基因改造的低免疫原性iPSC衍生的T细胞可能有助于现成的T细胞免疫疗法的产生。同时表明NOG-dKO(MHC-I- and MHC-II-knockout NOG)小鼠减少异种GvHD反应,这将增加iPS-T细胞的观察时间,并且能为iPS-T细胞治疗提供更准确的临床预测。
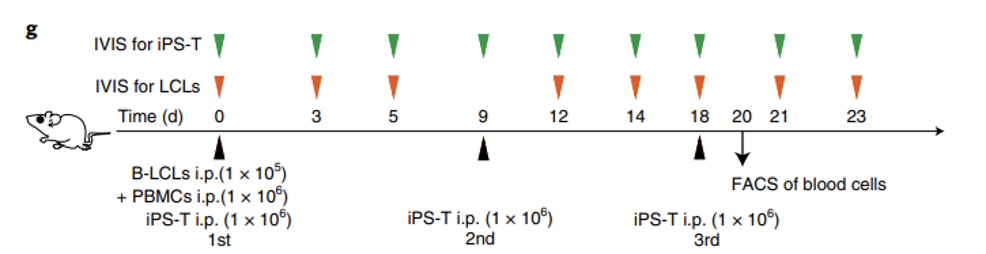
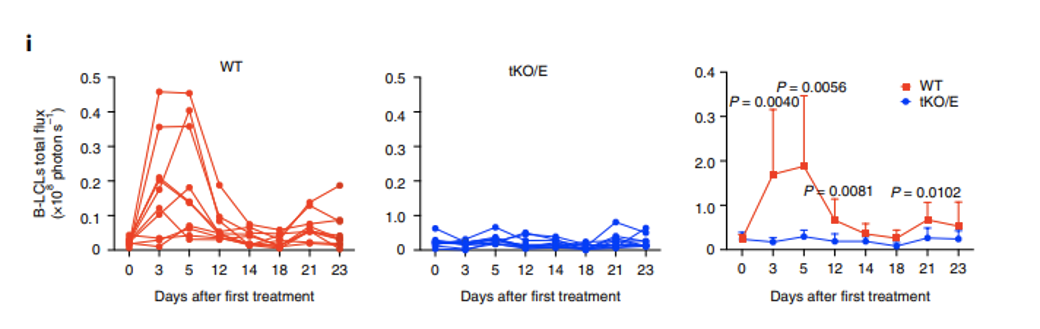
ang, B., Iriguchi, S., Waseda, M. et al. Generation of hypoimmunogenic T cells from genetically engineered allogeneic human induced pluripotent stem cells. Nat Biomed Eng 5, 429–440 (2021). https://doi.org/10.1038/s41551-021-00730-z
NOG-dKO小鼠的额外优势
利用NOG-dKO小鼠除了解决了部分CAR-T细胞疗法中窗口期短的问题,对CAR-T细胞因子风暴评估的准确及合理性也有重要的作用。
CAR-T细胞疗法显著的副作用之一就是可能会产生细胞因子风暴,需要在临床前进行合理的评估。临床上肿瘤患者接受CAR-T细胞疗法后,会出现CAR-T细胞的增殖,同时会产生细胞因子释放增多的现象,但随着肿瘤的消退,CAR-T细胞量及细胞因子释放量都会减少。但临床前在基础的NOG小鼠上,由于CAR-T细胞移植后Xeno-GvHD的产生,会导致非特异性T细胞的扩增,随着肿瘤的消退,细胞因子释放量也不会减少,与临床上的差异较大。
NOG-dKO小鼠由于消除了Xeno-GvHD, 除了更准确地评估T细胞治疗药物的药效外,对细胞因子的释放也可做初步的评估。目前已有一些CAR-T研发者倾向于使用NOG-dKO小鼠,除了可以满足长期的药效评估,同时还可进行细胞因子释放的评估。

CAR-T/TCR-T/TIL等治疗实体瘤的临床前“重要发现”:
2017 年,Dr. Jonas Nilsson 的研究发现,ACT 的抗肿瘤活性与细胞因子 IL-2 有关,hIL-2 NOG 自体肿瘤模型有助于重现患者对治疗的反应,而NOG小鼠无法重现。
2019 年,Elin Forsberg 的进一步研究发现,在 hIL-2 NOG 小鼠可观察到 HER2 CAR-T 治疗实体黑色素瘤的体内疗效 , 且这种功效仅在 hIL-2 NOG 模型中可见,而在基础的 NOG小鼠中并未出现。目前越来越多的研究表明,hIL-2 NOG 小鼠是评估临床前T细胞治疗实体瘤的重要模型。
NOG小鼠在血液瘤中可以很好地评估T细胞治疗效果。但在一些实体瘤中,由于小鼠中缺少人源的细胞因子IL-2等,复杂的肿瘤免疫微环境导致T细胞无法浸入,使得T细胞疗法无法在临床前得到有效评估。hIL-2 NOG小鼠中人源IL-2细胞因子的持续表达,将有利于更好地贴近临床患者的情况,得到更准确的临床预测。

2022AACR会议上,Lovance Biotherapeutics报道了一款基因修饰的TL细胞治疗(PDCD-1KO)的临床前体内治疗效果:
利用hIL-2 NOG小鼠,发现PDCD-1 KO TIL的治疗效果远高于MOCK TIL和PD-1联合给药组。表明了内源性的敲除PDCD-1将在TIL治疗中发挥非常重要的作用。这些结果表明PDCD-1 KO TIL(IOV-4001)是一种治疗实体瘤的非常有潜力的临床选择,该项成果即将在黑色素瘤及非小细胞肺癌中开展临床研究。
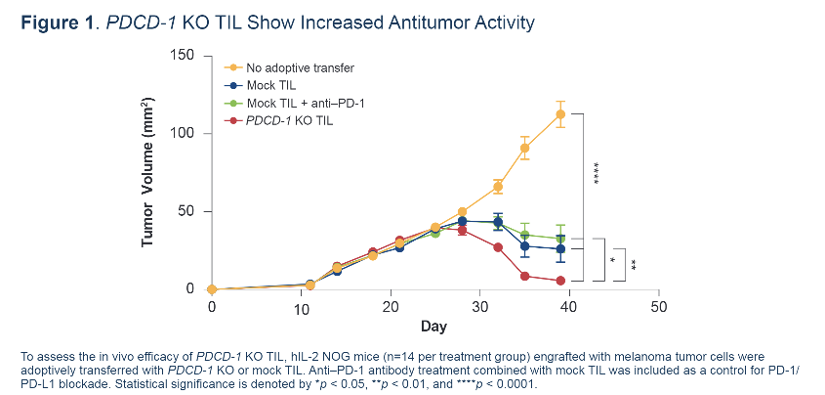
Preclinical Activity And Manufacturing Feasibility of Genetically Modified PDCD-1 Knockout(KO) Tumor-infiltrating Lymphocyte(TIL) Cell Thetapy.

提到NK细胞治疗,我们要清楚NK细胞与T细胞的增殖差异。NK细胞扩增需要通过白介素等外界因子的刺激作用,才能促使NK细胞自我复制和增殖。
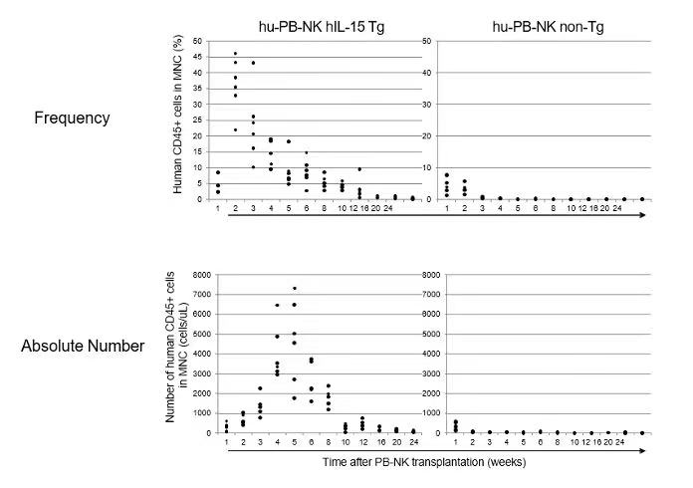
日本CIEA的研究数据表明,将人源的NK细胞直接移植到NOG小鼠中,移植后1-2周,在外周血中已检测不到人源NK细胞。而在hIL-15 NOG小鼠中,人源NK细胞移植后,NK细胞可维持12周以上,绝对数量在移植后4-5周左右达到峰值。
故临床前NK细胞治疗的药效评估,如果缺少人源细胞因子,NK细胞则无法发挥药效。hIL-15 NOG小鼠可持续表达人源细胞因子IL-15, 有利于动物体内人源NK的增殖及维持,从而进一步发挥抗肿瘤药效。
3.总结
NOG小鼠的超重度免疫缺陷特性,为细胞治疗的临床前药理药效及毒理评估提供了非常重要的数据支撑。但针对不同的细胞治疗、不同的癌种适应症及研发者不同的关注点等,我们需要根据实际情况选用不同的新一代NOG小鼠,以更好地模拟临床患者情况,提高准确性。
本文重点关注了细胞治疗中药理药效的动物模型选择,在动物模型中的临床前安全性评估同样不可忽视。NOG小鼠由于超重度免疫特性,可以为这些细胞治疗的致瘤性风险提供非常好的安全性评价。
NOG小鼠作为超重度免疫缺陷鼠,对细胞致瘤性非常敏感,且自发性肿瘤率极低,寿命长,是致瘤性安全测试的较好模型。日本NIHS(National Institute of Health Sciences )的研究结果表明,NOG小鼠是hiPSCs细胞药物致瘤性测试的优选模型。
NOG及新一代NOG小鼠尽管可以提供一些简单的药物毒性分析,但由于缺乏人源免疫系统,CAR-T无法模拟CRS在这些免疫缺陷小鼠中引起的级联反应,这些现象在临床患者中却可能会发生;另外,在这些模型中也无法评估CAR-T细胞和其他免疫细胞/组织之间的相互作用。目前没有一个完美的模型可以用来评估这些新兴细胞治疗的安全性,但有研究表明,免疫系统重建的人源化小鼠是目前预测神经毒性、细胞因子风暴评估、CAR-T对局部组织的影响和巨噬细胞激活综合征(MAS)的最佳临床前研究系统。