推荐产品
公司新闻/正文
新模型速递 | NOG-dKO 与大分子抗体药
人阅读 发布时间:2022-11-14 16:34
huPBMC人源免疫系统重建模型具有制备周期短,成本低、高水平转化率的优势,被广泛应用于多种靶点在T 细胞的肿瘤免疫药物研发中。但异源PBMC移植引起的异种Xeno-GvHD反应限制了其应用。
CAR-T 作为活的细胞类药物,进行临床前体内研究时,也会引起Xeno-GvHD反应,不能进行长时间的药效评估,且药效评估的准确性也受到影响。
本文将介绍一种新型品系:NOG-MHC I/II-2 KO (NOG-dKO) 小鼠,huPBMC移植或CAR-T 药物处理后无明显的xeno-GvHD,可准确评估PD-1等免疫检查点抑制剂、双特异性抗体、组合疗法以及CAR-T/TCR-T药物的抗肿瘤活性。
维通利华NOG-dKO小鼠已经量产,现货充足!

NOG-dKO与肿瘤免疫治疗
人源免疫系统重建模型为癌症的免疫治疗研究提供了良好的平台,已有大量的药物临床前验证数据获得临床上的验证,证明人源化小鼠将是评估人类免疫系统对抗癌症的重要临床前模型; 过去的十年中,重度免疫缺陷鼠NOG已成功地用来制作免疫系统人源化模型,其中将huPBMC移植到重度免疫缺陷鼠NOG上制备的人源化免疫系统模型,由于其制备周期短,成本低、高水平转化率等优势,被广泛应用于免疫检查点抑制剂双特异性抗体、多特异性抗体等靶点在T 细胞的肿瘤免疫药物研发中。
但异源PBMC移植会引起强烈的异种Xeno-GvHD反应,导致动物在4-6周内出现炸毛/活动性减弱/体重减轻/甚至死亡等现象,使整个肿瘤免疫治疗的研究周期限制在4-5周内,这限制了很多成瘤较慢的癌种适应症的研究,同时也限制了这些新型免疫检查点抗体与肿瘤疫苗或其他小分子组合疗法的研究。
突破GvHD限制
对此日本CIEA开发出一种新型品系:NOG-MHC I/II-2 KO (NOG-dKO) 小鼠(在NOG 小鼠基础上,敲除MHC I 类和Ⅱ类亚型的轻链基因,使得huPBMC 移植后,无法识别小鼠细胞表面的MHC,不能进行免疫攻击)。研究者发现这种人源化小鼠模型没有表现出明显的xeno-GVHD的迹象,存活时间比对照NOG小鼠长12周。Ashizawa T et al.曾报道,由于xeno-GVHD反应在NOG小鼠中诱导了非特异性T细胞激活并伴有PD-1的表达,因此在我们的NOG-dKO小鼠中,靶向PD-1的免疫疗法可以比在NOG小鼠中更准确地评价。这些研究结果表明,NOG-dKO小鼠将是评估人类免疫系统应对肿瘤的有力武器。
huPBMC-NOG-dKO研究实例

huPBMC-NOG-dKO小鼠 & PD-1抗体
目前已有7个PD-1抗体药物在国内外上市,其中信达的信迪利单抗已于2019年11月划入医保,为国内患者带来福音。这些PD-1抗体药物的大多数临床前研究是采用huPBMC移植NOG而制备的免疫系统人源化小鼠,但由于huPBMC移植引起的Xeno-GvHD反应,限制了很多成瘤较慢的癌种适应症的研究,同时也限制了这些PD-1抗体与肿瘤疫苗或其他小分子组合疗法的研究。
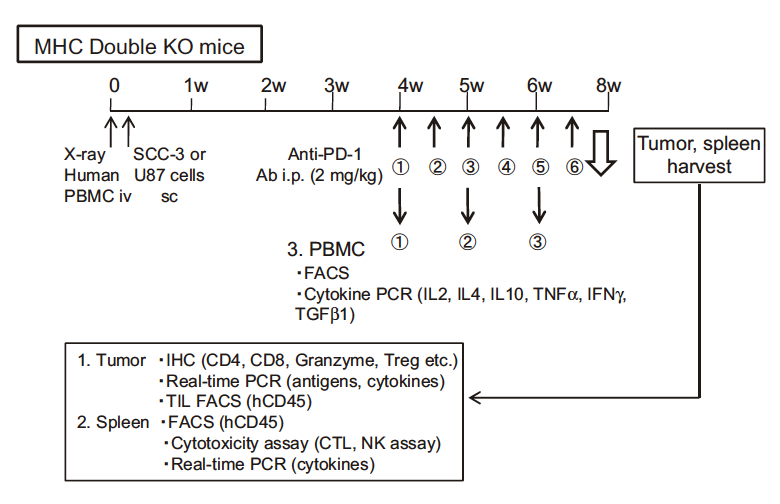
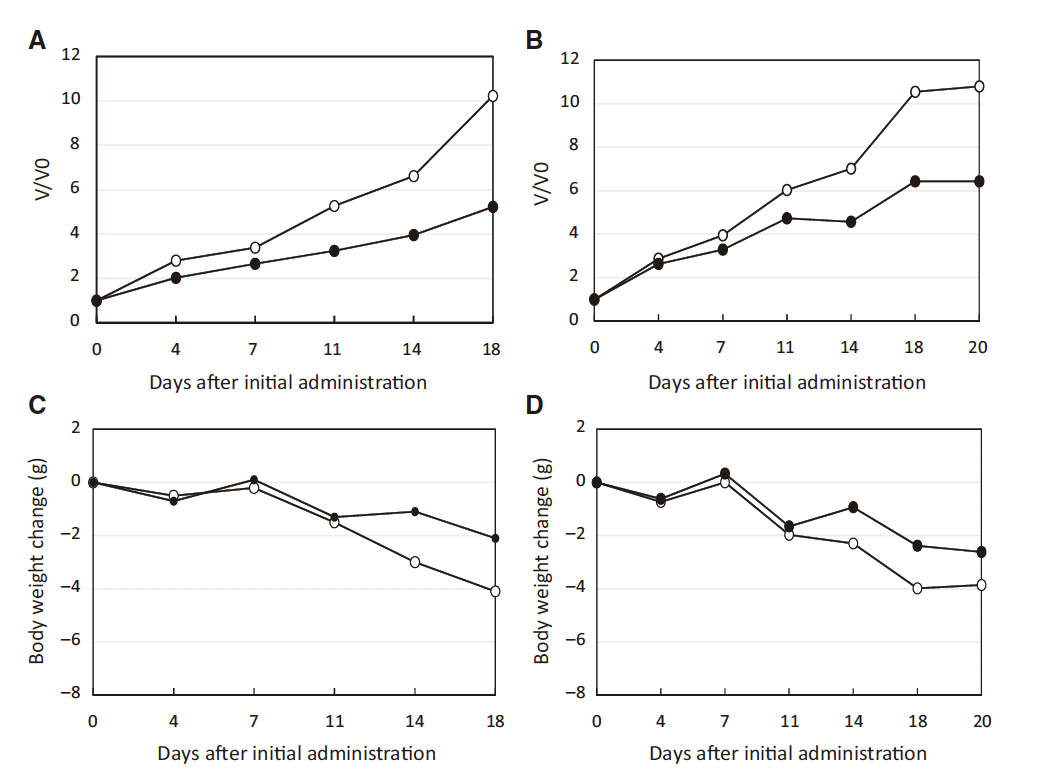
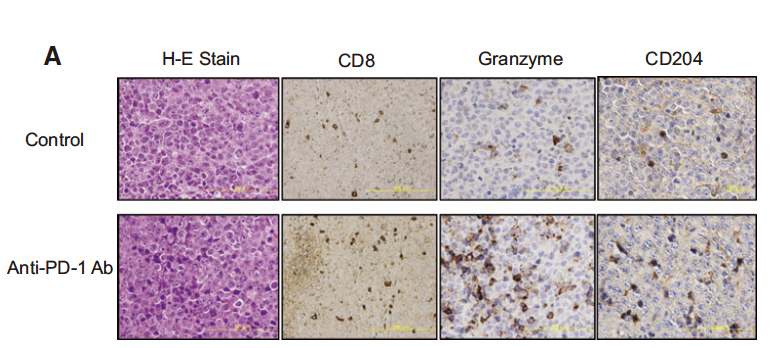
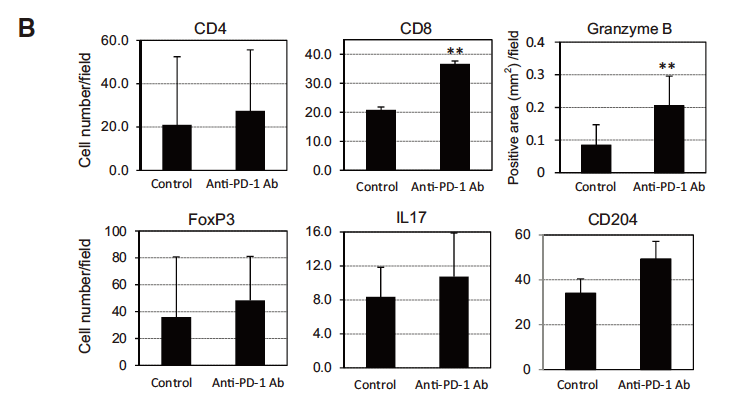
Tadashi Ashizawa et al.等研究者利用NOG-dKO小鼠移植huPBMC后制备的免疫系统人源化小鼠,测试了长达8周的PD-1抗体对SCC-3(人舌鳞癌细胞株)和U87(人神经胶质瘤细胞株)肿瘤的抑制作用。研究结果表明,PD-1抗体处理组,肿瘤体积减小50%以上。此外,在抗体处理组中观察到CTLs对SCC-3细胞的诱导和自然杀伤细胞活性的上调:肿瘤浸润淋巴细胞分析显示,抗体处理组肿瘤内部有更多PD1+TIM3+LAG3+阳性T细胞及granzymeCD8+T细胞浸润。 这些研究结果表明,NOG-dKO小鼠移植huPBMC后的免疫系统人源化小鼠,可作为一种有效的临床前免疫治疗模型,来评估当前的肿瘤免疫治疗药物。

huPBMC-NOG-dKO小鼠 & 双特异性抗体
虽然免疫检查点抑制剂如PD-1/PD-L1抗体研究已经取得了显著进展,但是其治疗响应率只有20%-40%左右。目前还有多种肿瘤免疫疗法研究在如火如荼的进行中,其中就包括双特异性抗体类药物。
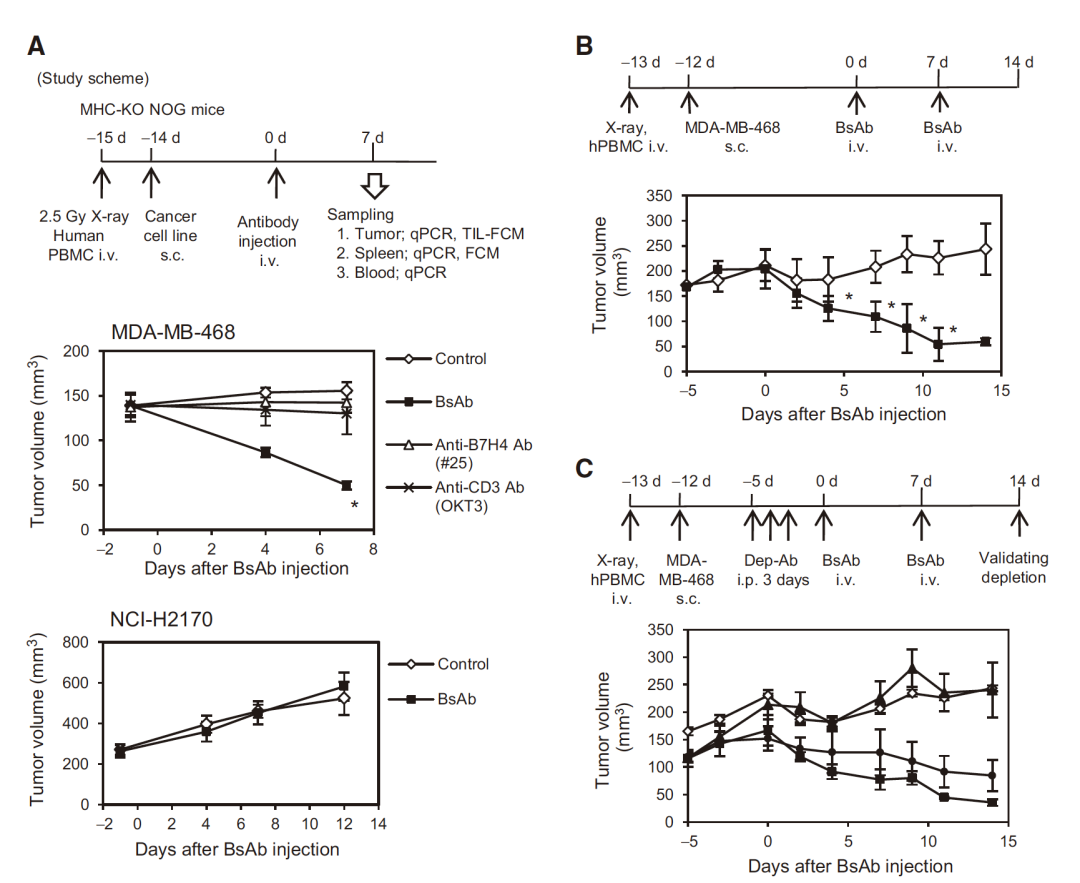
Akira Iizuka et al.的研究中将抗肿瘤药物靶点定在B7同源物4 (B7- h4, VTCN1),因为其是一种在许多人类癌症中过表达的免疫反应负调节免疫检查点分子。由此研究者制备了小鼠抗人B7-H4单克隆抗体,但其体内抗肿瘤效果不明显(可能是由于分子的不稳定性)。进而他们进一步研究开发了一种B7-H4/CD3双特异性抗体,并在体外和体内分析了其抗肿瘤活性。研究结果表明该双特异性抗体在体内和体外均有较好的抗乳腺癌效果,在体外分析实验中,与B7-H4 / CD3 双特异性抗体共同培养的hPBMCs成功溶解人类乳腺癌细胞株MDA-MB-468和其他B7-H4阳性细胞株。体内实验中,由于该双特异性抗体药物的一个靶点在人的T细胞,故其需要免疫系统人源化的小鼠模型。采用NOG-dKO小鼠移植huPBMC建立了人源化免疫系统模型,药效实验数据显示经B7-H4 / CD3 双特异性抗体可明显抑制MDA-MB-468, HCC-1954和HCC–1569等乳腺癌肿瘤的生长,且在肿瘤内部检测到CD8+T细胞和granzyme B+CTL的浸润,经过长期的观察,无GvHD副反应。

huPBMC-NOG-dKO小鼠 & 小分子抑制剂
STAT3是一种重要的肿瘤内部免疫调节因子,可在肿瘤部位以各种方式介导肿瘤诱导的免疫抑制作用。利用常规的裸鼠接种人源的肿瘤细胞已验证过特异性STAT3抑制剂的抗肿瘤效应,但由于裸鼠无T细胞,不能准确地表现STAT3抑制剂诱导的人类免疫反应。
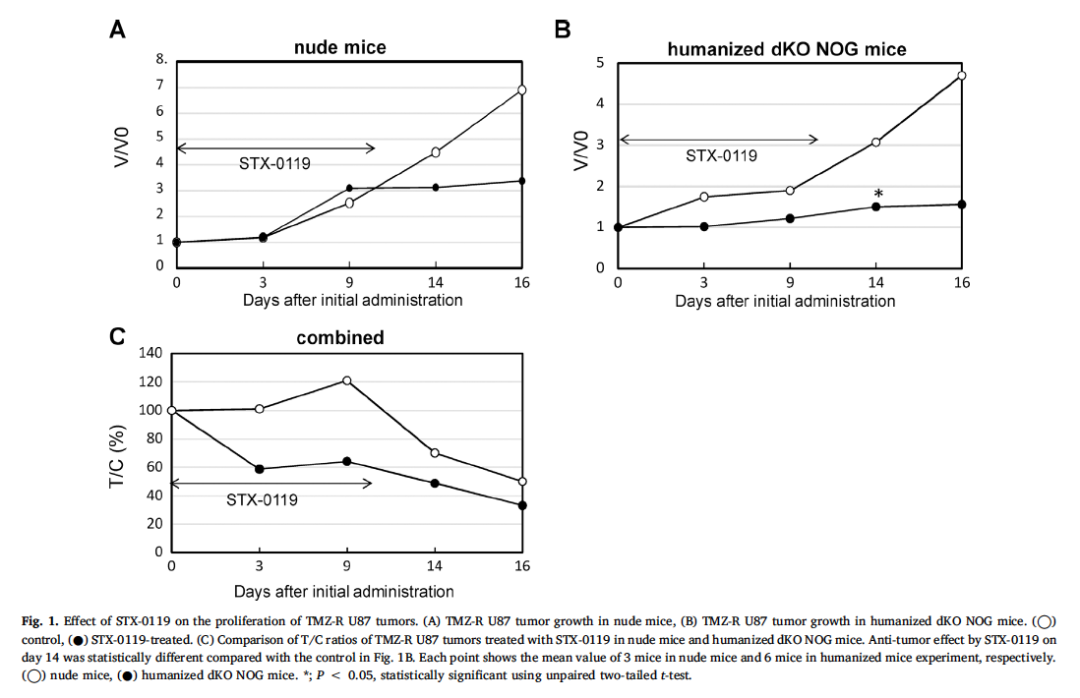
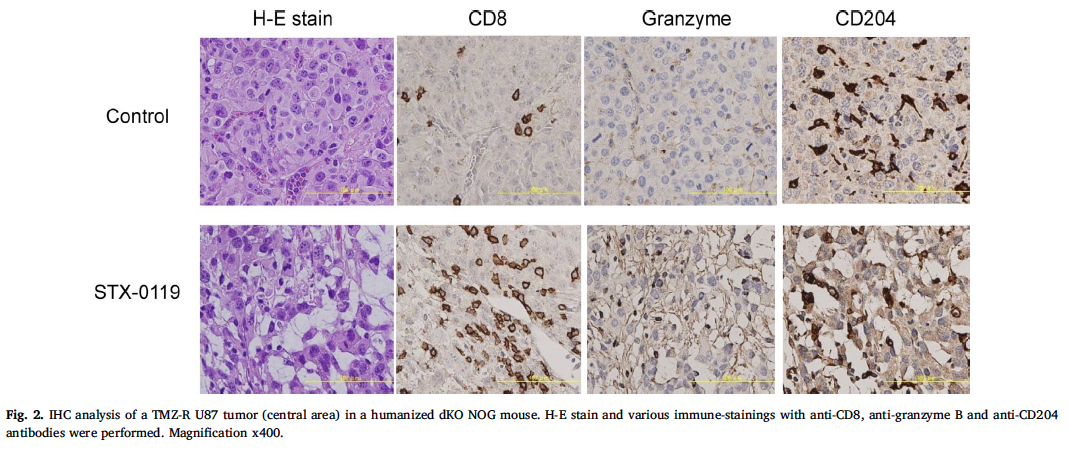
Yasuto Akiyama et al.研究者利用NOG-dKO小鼠,首先移植huPBMC建立了人源化免疫系统模型,研究了STAT3抑制剂STX-0119对tmz耐药(TMZ-R) U87胶质瘤的免疫作用,同时比较了STX-0119在裸鼠和人源化NOG-dKO小鼠模型中的抗肿瘤作用。研究结果表明,STX-0119可在裸鼠体内抑制TMZR U87肿瘤的生长,但与对照组相比,未促进肿瘤浸润淋巴细胞(TILs)的积累,而在人源化NOG-dKO小鼠中, STX-0119对肿瘤生长的抑制作用比在裸鼠中更迅速、更强,并且在肿瘤中发现大量以CD8+ T细胞和巨噬细胞为主的TILs。这些结果表明STX-0119具有通过促进肿瘤部位TIL积累而产生的抗肿瘤活性,人源化NOG-dKO小鼠模型可能是评估STAT3抑制剂对人类系统影响的有力工具。
参考文献
[1]. Yaguchi et al.: MHC class I/II deficient NOG mice are useful for analysis of human T/B cell responses forhuman tumor immunology research. Journal for ImmunoTherapy of Cancer 2013 1(Suppl 1):P39.
[2]. Tadashi, Ashizawa, Akira, et al. Antitumor Effect of Programmed Death-1 (PD-1) Blockade in Humanizedthe NOG-MHC Double Knockout Mouse.[J]. Clinical cancer research : an official journal of the American Association for Cancer Research, 2017.
[3]. Iizuka A , Nonomura C , Ashizawa T , et al. A T-cell-engaging B7-H4/CD3 bispecific Fab-scFv antibody targets human breast cancer[J]. Clinical Cancer Research, 2019.
[4]. Akiyama Y , Nonomura C , Ashizawa T , et al. The anti-tumor activity of the STAT3 inhibitor STX-0119 occurs via promotion of tumor-infiltrating lymphocyte accumulation in temozolomide-resistant glioblastoma cell line[J]. Immunology letters, 2017, 190.
[5]. Yaguchi T , Kobayashi A , Inozume T , et al. Human PBMC-transferred murine MHC class I/II-deficient NOG mice enable long-term evaluation of human immune responses[J]. Cellular & Molecular Immunology, 2017.